细胞培养及生理实验培训
细胞培养是现代生物医学研究中的基础技术,掌握正确的细胞培养方法对于实验的成功至关重要。
细胞复苏
在进行细胞复苏前,需要查阅说明书或相关文献,了解:
- 细胞的形态(表皮样、成纤维样或圆形)
- 细胞的生长特性(贴壁或悬浮)
- 细胞所需完全培养基(DMEM、RPMI-1640、DMEM/F-12等)
- 培养基选择:复苏用培养基需为该细胞最适培养用培养基(推荐查找网站ATCC或Procell)
- 及时复苏:收到细胞后最好尽快复苏,如要继续保存务必在液氮中保存。如在-70℃下,细胞的存活率将大大降低,甚至死亡。
- 快速融化:从液氮中取出冻存管,旋紧管盖,迅速置于37℃的水浴中不断摇晃,务必使冻存液在1分钟内融化。
- 稀释保护:将融化后的冻存液加入到10倍体积的新鲜培养液中,以稀释DMSO的浓度,避免细胞中毒。
- 温和处理:为将对细胞的伤害降低,亦可不离心直接将有冻存液的细胞接入培养瓶中,贴壁后更换培养基。
细胞传代
传代前需要明确细胞的基本特性:
- 细胞的形态特征
- 生长特性(贴壁或悬浮)
- 所需完全培养基类型
- 细胞传代比例
- 传代时机:细胞融合到80%就应传代。
- 接种密度:细胞接种数为5×10⁴~8×10⁵个/ml,传代密度太低时,细胞容易死亡。
- 胰酶消化:胰酶消化要时刻观察,通过显微镜观察细胞状态避免胰酶消化过度。
- 细胞收集:细胞离心时尽量在1000 r/min离心5 min,离心转速过大时间过长会对细胞造成很大伤害。
- 防污染措施:操作前做好灭菌工作,整个操作过程尽量靠近酒精灯。
细胞冻存
- 冻存设备:使用梯度冻存盒,梯度冻存盒需提前拿至室温中复温。
- 快速操作:DMSO对细胞有害,因此冻存和复苏操作要尽可能快。
- 冻存液保存:配置好的冻存液在4℃冰箱内可以暂存1周,在-20℃冰箱内可以保存一个月。不过最好还是现配现用、不要反复冻融。
- 培养基一致性:复苏时使用的培养基最好与冻存前使用的培养基一致。
细胞生理实验培训
细胞生理实验是研究细胞功能和药物作用机制的重要手段,主要包括细胞增殖、迁移等检测方法。
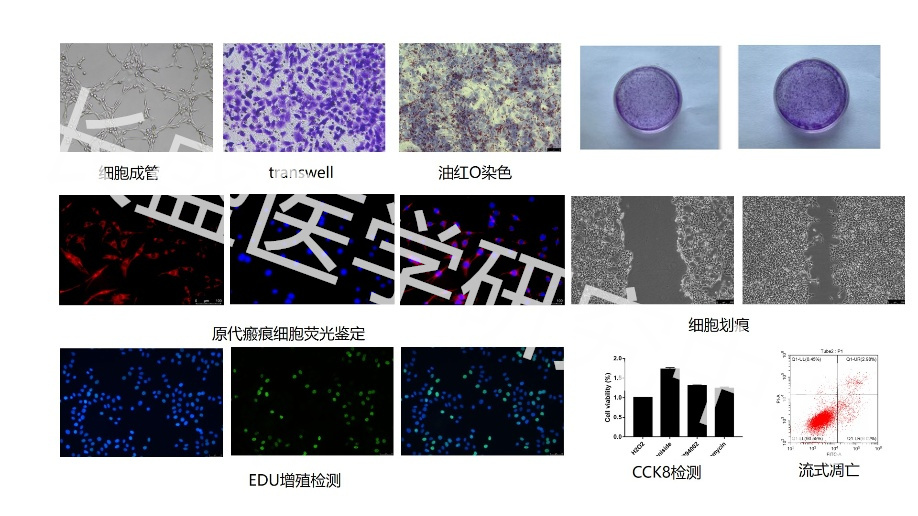
CCK-8检测细胞增殖
- 细胞接种:通常细胞增殖实验每孔加入100微升2000个细胞,细胞毒性实验每孔加入100微升5000个细胞(具体每孔所用的细胞的数目,需根据细胞的大小、细胞增殖速度的快慢等因素决定)。按照实验需要,进行培养并给予0-10微升特定的药物刺激。
- 试剂添加:每孔加入10微升CCK-8溶液。如果起始的培养体积为200微升,则需加入20微升CCK-8溶液,其它情况以此类推。可以用加了相应量细胞培养液和CCK-8溶液但没有加入细胞的孔作为空白对照。如果担心所使用的药物会干扰检测,需设置加相应量细胞培养液、药物和CCK-8溶液但没有加入细胞的孔作为空白对照。
- 孵育检测:在细胞培养箱内继续孵育0.5-4小时,对于大多数情况孵育1小时就可以了。时间的长短根据细胞的类型和细胞的密度等实验情况而定,初次实验时可以在0.5、1、2和4小时后分别用酶标仪检测,然后选取吸光度范围比较适宜的一个时间点用于后续实验。
Transwell检测细胞迁移
- 实验准备:不同细胞侵袭能力不一样,迁移能力和时间也会有不同,可查阅文献确定迁移时间及接种量。
- 避免气泡:避免下层培养液和小室间气泡产生,影响迁移能力。
- 膜完整性检查:在实验开始前,检查Transwell膜的完整性,确保没有破损或漏洞;加入细胞时注意不要戳破膜。
EdU检测细胞增殖
- 细胞铺板:将生长状况良好汇合度达到80%左右的细胞,去除培养基、PBS清洗、胰酶消化制备成单细胞悬液,血球计数板计数,以3×10⁴ cells/500 μL每孔接种于24孔板,接种5孔;于37℃、5% CO₂培养箱培养过夜,用于后续EdU法检测不同处理组细胞增殖状态。
- EdU检测:根据试剂盒说明书进行实验。
- 结果分析:荧光显微镜选择不同的视野拍照(一般选择3-5个视野),分别统计同一个视野内阳性细胞数和细胞总数,计算增值率做成统计图。
真实实验研究 上百项检测实验 6大实验平台